Farmakoterapie bolestí zad
Prim. MUDr. Marek Hakl, Ph. D.
Bolesti zad jsou nejčastěji způsobeny primárním vertebrogenním onemocněním. Roční prevalence výskytu bolestí zad se udává mezi 15-45%, celoživotní prevalence je 60-90%. Chronické bolesti bederní páteře se vyskytují u 3-7% dospělé populace a jsou příčinou 1/3 všech pracovních neschopností.
Podle délky trvání rozdělujeme bolesti páteře na akutní (dny až týdny), subchronické a chronické (měsíce až roky). Podle diagnostických kritérií rozlišujeme:
- Nespecifické bolesti zad, které jsou obvykle bez jasného organického původu
- Bolesti zad způsobené organickým postižením páteře, jako jsou např. úrazy, nádory, nebo lokální infekce
- Kořenové bolesti způsobené přímým drážděním nervového kořene.
Bolesti bývají pacienty velmi často popisovány jako ostré, palčivé, propagující se. To vede k úvahám, že vedle přítomnosti významné zánětlivé komponenty bolesti se přítomná i komponenta neuropatická a na výsledné bolesti se podílí mechanismy centrální senzitace.
Základem farmakoterapie akutních bolestí zad jsou neopioidní analgetika. Vzhledem k přítomnosti výrazné zánětlivé komponenty obvykle podávání samotného paracetamolu nestačí a je nutná jeho kombinace s nesteroidními antiflogistiky (NSA).
Princip účinku nesteroidních antiflogistik spočívá převážně v blokádě enzymů cyklooxygenázy (COX), která mění kyselinu arachidonovou na prostaglandiny. Existují dva isoenzymy COX-1 a COX-2. Forma COX-1 je syntentizována v řadě orgánů (játra, ledviny, žaludeční sliznice, krevní destičky) a podílí se na jejich fyziologické funkci. Hladina COX-2 výrazně stoupá při traumatu a zánětu a je spoluzodpovědná za zánětlivé a bolestivé projevy onemocnění.
Spíše vyjímečně je indikována slabá opioidní medikace, nejčastěji tramadol. Podávání myorelaxancii u bolestí zad je diskutabilní. Pokud se pro ně rozhodneme, délka jejich užívání by neměla přesáhnout 5-7 dnů. Farmakoterapie akutních bolestí zad může být doplněna reflexními obstřiky lokálním anestetikem, případně kortikoidem, infuzní terapií, akupunkturou nebo manipulací.
Závažnějšími potížemi jsou chronické bolesti zad, kde je multidisciplinární přístup k jejich léčbě nutností. Ve farmakoterapii vycházíme z převažujícího charakteru bolestí. V případě nociceptivní bolesti (převážně lokalizované do oblasti zad) postupujeme dle III. stupňového žebříčku léčby bolesti WHO. U mírných bolestí (VAS 0-4) doporučuje začínat s analgetiky 1. Stupně (neovoidní analgetika). Při nedostatečném efektu (středně silná bolest VAS 4-7) se přidávají slabá opioidní analgetika. Pokud i jejich efekt je nedostatečný nebo je bolest příliš intenzitní (silná bolest VAS 7-10), je indikovaná silná opioidní medikace.
Základním předpokladem úspěšné léčby bolestí je prevence, založená na změně životního stylu, pohybových stereotypů a především pravidelným cvičení.
Neopioidní analgetika.
Analgetika antipyretika
Paracetamol
Paracetamol patří mezi relativně bezpečná analgetika. Jednotlivá dávka se pohybuje v rozmezí 650 – 1000 mg, maximální denní dávka by neměla překročit 1000 mg. Nežádoucí účinky vzhledem k gastrointestinálního traktu (GIT) se mohou vyskytnout pouze v kombinaci s NSA. Obezřetnosti je třeba dbát při nekontrolovaném užívání, zejména díky jeho volnému prodeji. Při léčbě chronické bolesti je používán jako doplňkové analgetikum, při setrvalém užívání by neměla být překročena denní dávka 2 g. Výhodou paracetamolu je jeho cena, dostupnost, minimum nežádoucích účinků. Paracetamol je jen vzácně přísně kontraindikován (hladovění, malnutrice, aktivní hepatopatie, abúzus alkoholu).
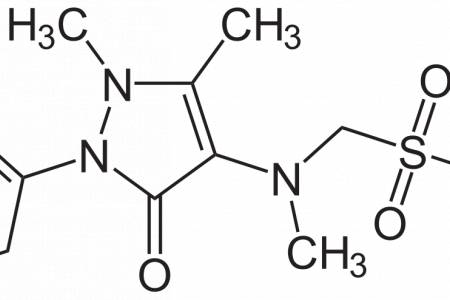
Bazické pyrazolony – metamizol.
Metamizol se používá v jednotlivých dávkách 500-1000 mg a maximální denní dávce 4000-5000 mg denně. Pyrazolony mají velmi dobrou analgetickou účinnost a minimum nežádoucích účinků. Vzácně mohou způsobit poruchu krvetvorby a nejsou vhodná pro dlouhodobou analgetickou léčbu.
Nesteroidní antiflogistika a antirevmatika
Neselektivní NSA
Ibuprofen
Ibuprofen v dávkách do 1200 mg denně patří mezi v dávkách patří vzhledem ke GIT k šetrným NSA .Dobrých analgetických účinků dosahuje už při jednotlivých dávkách 200 mg. Maximální denní dávka je 2400 mg. Ibuprofen je vhodný i v pediatrii. Ruší antiagrtegační účinek kyseliny acetylsalicylové.
Diclofenak
Diclofenak je v dávce 50 mg obdobně analgeticky účinný jako ibuprofen 400 mg. Diclofenak je vzhledem ke GIT v rámci skupiny NSA středně rizikový, má však vyšší riziko kardiovaskulárních (KV) příhod. Při používání diclofenaku je nutné rozlišovat mezi IR lékovou formou s dobou účinnosti 6-8 hodin, retardovanou formou s až 24 hodinovým účinkem. Tomu je zapotřebí přizpůsobit dávkování léku. Maximální denní dávka je 150 mg.
Piroxicam
Piroxicam má velmi dlouhý poločas eliminace (asi 50 hodin). To zodpovídá za velmi dlouhý analgetický účinek , ale i pomalejší nástup analgetického efektu. Piroxicam patří mezi NSA s nejvyšším GIT rizikem komplikací. Maximální denní dávka je 20 mg.
Naproxen
Naproxen má eliminační poločas 13 hodin, tím se řadí mezi NSA s nejdelším poločasem. V některých zemích patří mezi nejpoužívanější NSA. Mezi jeho výhody patří dobrý
analgetický efekt a nejnižší riziko KV příhod ze všech NSA, má střední riziko GIT nežádoucích příhod. Jednotlivá dávka se pohybuje okolo 500 mg, maximální denní dávka je do 1000 mg.
Ketoprofen
Účinný je pravotočivý dexketoprofen, má nejrychlejší nástup účinku. Analgeticky patří mezi nejpotentnější NSA, má však vysoké riziko krvácení do GIT. Maximální denní dávka je 300 mg.
Indometacin
Indometacin má silný analgetický účinek a vysoké riziko krvácení do GIT. Relativně časté jsou nežádoucí účinky z oblasti CNS (vertigo, cefalea, nauzea …) není vhodný pro dlouhodobé užívání. Specifickou indikací Indometacinu je chronická paroxysmální hemikranie. Maximální denní dávka je 200 mg.
Aceclofenac
Aceclofenac je šetrný vůči GIT, analgetický efekt je srovnatelný s jinými NSA. Maximální denní dávka je 200 mg.
Preferenční COX 2 inhibitory
Nimesulid
Nimesulid má velmi dobrý analgetický efekt, je relativně šetrný vůči GIT. Jeho užívání omezil SUKL na max 15 dnů. Dobou nástupu analgetického efektu patří mezi nejrychleji nastupující NSA, je určen pro léčbu akutní bolesti. Neměl by být podáván pacientům s jaterním onemocněním.
Meloxicam
Meloxicam je podle SPC určen pouze pro revmatické onemocnění, v zahraničí je však běžně používán i v jiných indikacích. Maximální denní dávka je 15 mg. Výhodou je dlouhý poločas umožňující dávkování 1 x denně.
Selektivní COX 2 inhibitory
Celecoxib
Jeho indikace je osteoartrosis a revmatoidní artritis. Jednotlivá dávka je 100-200 mg, maximální denní dávka 400 mg.
Parecoxib
Parecoxib je jediným injekčním koxibem, v léčbě bolestí zad ho lze použít při infuzní terapii místi neselektivního NSA u pacientů, kde je vysoké riziko krvácení z GIT. Paracoxib je „prodrug“, účinnou látkou je parecoxib.
Etoricoxib
Etoricoxib je nejrychleji nastupujícím lékem ze skupiny COX2 selektivních NSA, má velmi dobrý analgetický efekt avšak i nejvyšší riziko KV nežádoucích příhod z celé skupiny NSA.
Opioidní analgetika
Slabé opioidy:
Ve srovnání se silnými opioidy mají sice slabší analgetický efekt, ale s jejich vedlejšími účinky (nevolnost, obstipace, ovlivnění kognitivních funkcí atd.) je nutno rovněž počítat. Farmakologicky jde o slabými m agonisty, k jejich zástupcům patří tramadol, kodein, dihydrokodein.
Tramadol
Hlavní výhodou tramadolu je relativně nízké riziko zácpy, dobrá biologická dostupnost po perorální aplikaci a velký počet lékových forem. Někteří pacienti však po něm mívají závratě nebo nauzeu, vzácněji i jiné nežádoucí účinky. Analgetický účinek tramadolu lze výrazně zvýšit současným podáváním paracetamolu. Maximální denní dávka je 400 mg. Kombinovaný preparát 650 mg paracetamolu a 75 mg tramadolu se výborně umístil v oxfordské lize analgetik (seřazení analgetik podle jejich účinnosti). Parenterální tramadol se aplikuje intramuskulárně, subkutánně nebo intravenozně (velmi pomalu, lépe v infuzi). Jednotlivá dávka 50-100 mg s.c., i.m. nebo i.v., aplikaci možno opakovat ve 4-6 hodinovém intervalu. Neměla by být překročena celková denní dávka 400 mg. Opatrnosti je třeba dbát u pacientů s rychlým navyšováním dávek, v klinické praxi je popisován vznik těžko odklonitelné závislosti.
Kodein
Kodein je analgeticky poměrně slabý, a proto se používá prakticky jen v kombinacích, nejlépe s paracetamolem. Dostatečnou dávkou u dospělého je alespoň 650 mg paracetamolu + 60 mg kodeinu. Maximální denní dávka je 240 mg.
Dihydrokodein
Analgetická účinnost dihydrocodeinu je po perorálním podání o něco lepší než u kodeinu. Účinné jsou jeho morfinové metabolity. Maximální denní dávka je 240 mg.
Silné opioidy:
Silné opioidy jsou plnými antagoniskmy na µ opoidních receptorech a jsou určeny pro léčbu intenzivní neztišitelné bolesti, kterou nelze dostatečně zmírnit neopioidními analgetiky nebo slabými opioidy. Stropový efekt u většiny silných opioidů není dán, v klinické praxi však není vhodné překročit denní dávku ekvianalgetickou k 120-180 mg morfinu p.o.
Morfin
Morfin představuje opioid s největšími klinickými zkušenostmi. Jeho výhodou je nízká cena. Pro léčbu bolestí zad jsou vhodné pouze perorální formy podání. Morfin je k dispozici jak v retardované formě s 12 hodinovým efektem, tak v rychle nastupující formě. Tu v současné
době používáme pouze na krátkodobé zvýšení účinnosti retardovaného morfinu nebo na zlepšení jeho efektu při „nedotahování“ 12 hodinového intervalu účinku.Nevýhodou morfinu jsou toxické metabolity.
Fentanyl
V léčbě bolestí zad používáme pouze trandermální terapeutický systém (TTS) a to především u těžkých chronických stavů doprovázených silnou až velmi silnou bolestí. Výhodou TTS je stabilní plazmatická hladina a třídenní interval podávání. Individuálně lze tento interval zkrátit nebo prodloužit až o 1 den. Ve srovnání s p.o. morfinem byl u TTS fentanylu zaznamenán nižší výskyt zácpy.
Hydromorfon
Hydromorfon je efektivní µ agonista, mez jeho výhody se řadí předvídatelná farmakokinetika, farmakodynamika, nízká vazba na plazmatické bílkoviny, nezávislost metabolizmu na CYP450 a využitelnost u renální insuficience. Hydromorfon nemá analgeticky účinné metabolity.
Oxycodon
Oxycodon jek dispozici v tabletách s postupným uvolňováním, nově i v rychle nastupující formě (5,10,20 mg). K dispozici je jak v monokomponentních tabletách tak v kombinaci s naloxonem. Tento kombinovaný preparát při stejných analgetický účincích nezpůsobuje opioidy indukovanou střední dysfunkci. U jedinců s deficitním metabolismem CYP2D6 (10-12% euroasijské populace) může mít snížený analgetický účinek. Oxycodon je využitelný u pacientů s renální insuficiencí. Klinické studie prokázaly analgetiký účinek naloxonu i u neuropatické bolesti srovnatelný s gabapentinoidy a amimtriptylinem.
Buprenorfin
Z farmakologického hlediska je buprenorfin parciálním agonistou na µ receptorech a antagonistou na ĸ receptorech. Přesto je řazen do skupiny silných opioidů, protože vyšší dávky jsou ekvianalgetické jiným silným opioidům. Pro léčbu bolestí zad a kloubů se používá v transdermální formě s 72-96 hodinovým účinkem. Maximální dávka je dle SPC 140 µg. Buprenorfin má velmi dobrou tolerabilitu u seniorů a je vhodným opioidem u pacientů s chronickou renální insuficienci.
Tapentadol
Tapentadol je poslední syntetizovaná opioidní molekula vykazující duální mechanismus účinku (MOR-NRI) a představuje novou třídu analgetik. Analgetický potenciál u nociceptivní bolesti zajišťuje agonistická aktivita na µ opioidním receptoru, na tlumení neuropatické bolesti se potom pravděpodobně podílí blokáda zpětného vychytávání noradrenalinu na nervových zakončeních CNS. Tapentadol nemá aktivní metabolity, vazba na plazmatické proteiny je nízká. Z klinického pohledu vyniká především nízkým výskytem nežádoucích účinků a nízkým potenciál k lékovým interakcím. Výhodou je i jeho dostupnost jak v retardované formě, tak i v tabletách s rychlým uvolněním (50,75 a 100 mg). Maximální doporučená denní dávka je 500 mg.
Kriteria pro zahájení léčby opioidy
1. Léčba opioidy je indikovaná u nemocných, u kterých v léčbě chronické bolesti selhaly standardní léčebné postupy. Rozhodující je intenzita bolesti, ne její původ. Léčba opioidy, by ve vybraných případech (např. abusus alkoholu a psychotropních látek, nejistá sociální anamnéza, poruchy chování, nejasná příčina bolesti) měla být zahájena, či alespoň konzultována, na specializovaném pracovišti léčby chronické bolesti. K léčbě opioidy je indikován nemocný, jehož kvalita života je chronickou bolestí výrazně alterována. Další terapie, která přispívá k dosažení úlevy od bolesti, by měla být ponechána (např. TENS, antidepresiva, léčebná rehabilitace, psychoterapie….).
2. Bolest musí být opioid-senzitivní. K určení citlivosti chronické bolesti na opioidy je pro klinickou praxi přínosnější pomalá titrace opioidu prováděná ambulantně.
3. Zvolená aplikační forma léčiva by měla být pro pacienta uživatelsky jednoduchá s minimem nežádoucích účinků. Tuto podmínku splňuji perorální formy opioidů. Transdermální formy opioidů jsou přínosné u pacientů s poruchami GIT s nemožností užívání perorálních přípravků. Důležité je důkladné seznámení pacienta se správnou aplikační technikou.
4. Měla by být preferována léčiva s výhodnějším profilem nežádoucích účinků, zejména těch, na které nevzniká tolerance a mohou dlouhodobě negativně ovlivňovat zdravotní stav a spolupráci pacienta na léčbě.
5. V prvních dnech po novém nasazení opioidů jsou nezbytné alespoň telefonické kontroly stavu pacienta k monitoraci efektu terapie a možných nežádoucích účinků. U starších pacientů je vhodný kontakt s rodinou.
6. Indikující lékař by měl být dobře seznámen s psychosociální situací nemocného. Významná je anamnéza abuzu alkoholu, psychotropních látek a léků (benzodiazepiny, barbituráty apod.), kouření cigaret. Pozitivní anamnéza abuzu je relativní kontraindikací pro léčbu opioidy.
7. Dlouhodobá léčba opioidy je možná jen tehdy, je-li navozena vzájemná důvěra mezi lékařem a pacientem. Léčba opioidy není právem ani privilegiem nemocného. Nemocný musí být dobře informován o možných vedlejších účincích a potenciálním riziku této léčby. Je doporučeno získání informovaného souhlasu s podpisem pacienta. Nemocný se tak podílí na rozhodování o typu léčby, více akceptuje faktická rizika spojená s podáváním opioidů a lépe dodržuje pravidla terapie.
8. Stanovení reálných cílů léčby.
9. Léčba musí být analgeticky efektivní a měla by vést ke zvýšení funkční kapacity nemocného a rozsahu jeho denních aktivit. V průběhu léčby je nutno opakovaně hodnotit, zda jsou naplňovány dva základní cíle léčby: úleva od bolesti a zlepšení funkce. Izolované navození psychického komfortu se zhoršením funkčního stavu (funkce psychické, fyzické, sociální) je důvodem k přerušení léčby opioidy. V některých případech však nelze při limitujícím somatickém postižení očekávat zlepšení fyzických funkcí.
10. Pravidelné kontroly jsou nezbytné pro adekvátní monitoraci stavu pacienta a dodržování léčebného režimu. Po celou dobu léčení musí být vedena přesná a odpovídající dokumentace.
11. Za předpis opioidů musí být zodpovědný jeden lékař (jedno pracoviště).
12. Užívání opioidů může vést ke snížení schopnosti soustředění a udržení pozornosti a tím může být ohrožena schopnost řízení motorových vozidel a obsluha strojů. Tyto činnosti je nutno absolutně vyloučit v období titrace a v době, kdy se mění dávkování opioidu. Řízení motorového vozidla je vždy osobní zodpovědností jedince.
13. Pacient by měl být vybaven průkazkou o léčbě opioidy.
Kriteria pro přerušení léčby opioidy
1. Nedosažení efektivní analgezie. U nemocného s chronickou bolestí však i nevelký pokles ve VAS (vizuální analogová stupnice 0 – 10; např. z 8 na 6), neuspokojivý pro léčení akutní bolesti, může být pro nemocného s chronickou bolestí přínosný.
2. Nedostatečné zvýšení rozsahu aktivit a izolované ovlivnění psychiky v euforizujícím smyslu.
3. Nekontrolované zvyšování dávky, užívání nepředepsaných léků, nedodržení léčebného režimu.
4. Střídání lékařů a snaha sehnat opioidy jinde. Ad 3 a 4 koresponduje se známkami psychické závislosti - jde o projevy adiktivního chování (1)
Adjuvantní analgetika pro léčbu neuropatické bolesti
Bolesti zad mají často charakter smíšené nebo i čistě neuropatické bolesti. V těchto případech jsou lékem první volby antikonvulziva a antidepresiva.
Antidepresiva
Mezi antidepresiva používané v léčbě europatické bolesti jsou tricyklická antidepresiva (TCA) (amitriptilyn, notriptilyn, imipramin, clokipramin) a moderní antidepresiva ze skupiny SNRI (velafaxin, duloxetin). Venlafaxin vykazuje dobrý analgetický účinek srovnatelný s TCA a přitom nízký výskyt nežádoucích účinků. Z nich se nejčastěji objevují
gastrointestinální obtíže, vysoký krevní tlak a změny na EKG. Efektivita duloxetinu byla srovnatelná s gabapentinem a pregabalinem. Analgetický efekt SSRI antidepresiv prokázán nebyl, pacientovi však mohou být nápomocné při změnách depresivního ladění.
Antikonvulziva
Pregabalin
Efekt pregabalinu v léčbě polyneuropatie potvrdilo několik studií, některé s negativním výsledkem pro dávku 150 mg/denně, avšak s velmi dobrým efektem pro dávku 300–600 mg/denně (2).
Gabapentin
Pro dosažení maximálního analgetického efektu je doporučováno dosažení úvodní dávky 1800-2400 mg denně, teprve při dostatečném analgetickém efektu je možno tuto dávku snížit na „udržovacích“ 900 mg denně.
Karbamazepin
Užití Karbamazepinu je limitováno častým výskytem nežádoucích účinků (závratě, ospalost, rozostřené vidění) a farmakologickými lékovými interakcemi. U pacientů netolerujících tuto léčbu je jako lék druhé volby doporučován lamotrigin a baclofen (2)
Myorelaxancia
Podávání myorelaxancii je diskutabilní, pro jejich použití neexistuje jednoznačný konsensus. Většina studií prokazuje při krátkodobém používání zlepšení bolestí (3,4). Při jejich podání je však třeba brát v potaz skutečnost, že zejména při dlouhodobější aplikaci může být ovlivněn i tonus normotonických svalů, a může tak paradoxně dojít k narušení rovnováhy celého svalového korzetu a v konečném důsledku i ke zhoršení klinického stavu nemocného. Myorelaxancia by tedy měla být vždy podávána maximálně uvážlivě a vždy s ohledem na poměr přínosu a potenciálního rizika. Na tuto skutečnost je třeba pomýšlet především u myorelaxancií se současným hypnosedativním účinkem, jenž může omezovat pacienta v jeho běžných denních aktivitách (4). Pokud se pro ně rozhodneme, délka jejich užívání by neměla přesáhnout 5-7 dnů (5).
Kanabinoidy
Konopí (kanabis, marihuana, hašiš) je v medicině používáno více než 10 000 let. Nejdříve bylo pravděpodobně pěstováno v centrální Asii. Konopí je velmi nenáročná rostlina rostoucí v mírném i tropickém pásmu až do nadmořské výšky 2400 metrů. Nejčastější druhy jsou Cannabis sativa a indica. Roste až 15 cm za den a dorůstá výšky až 6 metrů. Je to dvoudomá rostlina, které stačí jen malé množství vody. Jak samčí tak samičí varianta kanabisu vytváří jantarově zbarvenou pryskyřici bohatou na kanabinoidy. Využití konopí bylo odjakživa všestranné. Sloužilo jako základní surovina pro výrobu látek na oblečení, provazů, lan a plachet. Konopný olej byl využíván až do II. světové války v USA jako pohonná hmota do aut. Konopí jako jedna z nejstarších léčivých rostlin nalezlo využití i v medicině, nejdříve pravděpodobně v Číně. Používalo se k tišení bolesti např. v průběhu porodu a jiných bolestivých stavů, k léčbě astmatu, dyzenterie, spazmů a křečí. V roce 1839 popsal irský lékař W.B. O´Shaugnessy, pracující v Indii, léčebný potenciál konopí. V průběhu dvacátého století však vývoj nových účinných léků se specifickým účinkem zatlačil léčebné využití kanabisu jako léčivé rostliny do pozadí. Od šedesátých let se kanabis začal uplatňovat jako droga se schopností navodit psychické uvolnění a stav duševní pohody. Kanabis obsahuje asi 460 chemických substancí a z toho více než 120 z nich má kanabinoidní strukturu. V roce 1964
Y. Gaoni a R. Mechoulam určili jako hlavní ingredienci zodpovědnou za psychoaktivní účinek marihuany tetrahydrokanabinol. Dalším účinným kanabinoidem je kanabidiol. Tyto objevy a také některé zajímavé klinické zkušenosti předznamenaly nový zájem o léčebné využití kanabisu. Podobně jako byl nalezen u lidí endogenní opioidní systém, stejně tak byl v roce 1990 objeven endogenní kanabinoidní systém. Lze identifikovat dva základní kanabinoidní receptory: CB1 a CB2. CB1 receptory jsou především v CNS (mozková kůra, hipokampus, amygdala, bazální ganglia, substancia nigraglobus pallidus, mozeček) a jejich distribuce napovídá o vlivu kanabinoidů na krátkodobou paměť a motoriku. Řídký výskyt CB1 v mozkovém kmeni (centra řízení vitálních funkcí) koresponduje z nízkou toxicitou i vysokých dávek samotné marihuany. CB2 receptory jsou lokalizovány v buňkách imunitního systému. Byla identifikovány i endogenní kanabinoidy – anandamid, 2-arachidonoylglycerol a další. Endogenní kanabinoidy mají modulační roli. Učinkují pravděpodobně jako retrográdní chemický posel přestupující synaptickou štěrbinu a v presynaptické oblasti způsobí snížené uvolnění GABA a glutamátu.
Ukazuje se, že kanabinoidy jsou látky, které mohou ovlivnit velmi složitý a doposud ne zcela objasněný mechanismus bolesti. Prokazatelný je účinek u nádorové bolesti a u neuropatické bolesti, kde se uplatňuje celá řada patofyziologických mechanizmů (neuroplasticita, fenomén wind up, sprouting, hyperexcitabilita apod). Kromě toho je prokázán příznivý účinek kanabinoidů na spasticitu u některých neurologických onemocnění a na bolest u roztroušené sklerózy (RS) a HIV asociované neuropatie. U nádorové bolesti je vítaným i jejich antiemetický efekt a zlepšení chuti k jídlu. Pozitivní je i ovlivnění spánku. Vedlejší účinky kanabinoidů odpovídají jejich určitému psychotropnímu potenciálu, existuje pravděpodobně velká individuální vnímavost podobně jako u opioidů či psychofarmak. Vedlejší účinky však nebývají závažné. Poměr riziko/prospěšnost je příznivý (6,7)
V algeziologii je hlavní indikací neuropatická bolest. V ČR je konopí dostupné v lékárnách na speciální elektronický recept. Povolená je inhalační cesta podání pomocí vaporizeru nebo perorální. Pacienti si jednotlivé dávky mohou sami připravovat dle doporučení lékaře nebo užívat v lékárnou připravovaných kapslích.
Infuzní léčba
Infuzní terapie se stala běžnou součástí léčebné strategie léčby bolestí zad
Tato metoda se využívá v léčbě pooperační bolesti, chronické bolesti, tak i netraumatické akutní bolesti. Zatímco pozice infuzní terapie v pooperační bolesti je obsažena stanovena není. Nejsou dána indikační kriteria, vhodné diagnózy ani optimální složení infuzní analgetické směsi. Stejně tak chybí i data porovnávající efektivitu směsí různých složení. Indikace a složení infuzní terapie se nejčastěji řídí zvyklostmi pracoviště, které se vzájemně od sebe často velmi liší. Klinické studie porovnávající účinek infuzní terapie s ostatní léčbou se zaměřuji na infuze Neodolpasse. Nejčastější indikací infuzní terapie jsou bolesti pohybového aparátu, zejména bolesti zad s nebo bez radikulární složky, periferní neuropatické bolesti případně KRBS nebo úžinové syndromy. Obvyklé složení analgetické směsi obsahuje analgetikum (preferenčně NSA k pokrytí zánětlivé komponenty), myorelaxans případně lokální anestetikum (mesocain) k ovlivnění neuropatické komponenty. Infuze Neodolpasse obsahuje diclofenak 75 mg a orfenadrin, který pravděpodobně odpovídá za specifičnost efektu této směsi. Orfenadrin je centrální myorelaxans se slabě antihistaminickým a lokálně anestetickým efektem. Zároveň ovlivňuje zpětné vychytávání noradrenalinu v CNS a má antagonistický účinek na NMDA receptory. Orfenadrin ovlivňuje nejenom spastickou komponentu bolesti, ale má přiznivý vliv i na neuropatickou složku bolesti.
Literatura:
1. Metodické pokyny pro farmakoterapii akutní a chronické nenádorové bolesti. Bolest 2016;suppl 2.
2. Atta N., Cruccu G., Baron R., Haanpaa M., Hanson P., Jensen T., Numikko T. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2009 revision. European Journal of Neurology 2009;8:1010-1018.
3. 2. Chou, R., Peterson, K., Helfand, M.: Comparative efficacy and safety of skeletal muscle relaxants for spasticity and musculoskeletal conditions: a systematic review. J Pain Symptom. Manage. 2004; 28: 140–175.
4. 3. van Tulder, M. W., Touray, T., Furlan, A.D., Solway, S., Bouter, L. M.: Muscle relaxants for nonspecific low back pain: a systematic review within the framework of the cochrane collaboration. Spine 2003; 28: 1978–1992.
5. Slíva J. Myorelaxancia ve světle Evidence Based Medicíny. Practicus 2008, 5:27-29.
6. Devane WA, Hanuš L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, Gibson D, Mandelbaum A, Etinger A, Mechoulam R.: Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 1992, 258, 1946–1949.
7. DiMarzo V, Wang J.: The Endocannabinoid system. The World of Endocannabinoids and Related Medicators. Academic Press; Sept. 2014.

 Nechci bolest
Nechci bolest