Léčba bolestí u nádorů močového měchýře a prostaty
MUDr. Marek Hakl
Bolest patří mezi nejčastější doprovodné příznaky probíhajícího nádorového onemocnění. Bolest se u onkologických pacientů výrazně podílí na snižování kvality života, často strach z bolestivého průběhu onemocnění je výraznější než strach ze smrti samotné. Udává se, že průměrně 80 % onkologických pacientů se někdy v průběhu onemocnění setkává s bolestí hodnocenou jako „silná“. V 60-90 % jsou tyto bolesti způsobené vlastním nádorem, v 10-25% jsou spojené s protinádorovou léčbou a v 5-20 % s celkovým oslabením organizmu. Bez vztahu k nádorovému onemocnění je asi 3-10 % bolestí (bolesti zad při degenerativním postižení páteře, artrózy aj). Odlišný je i výskyt bolestí u jednotlivých typů nádorového onemocnění. Mezi nejbolestivější patří nádorové postižení kostí a slinivky břišní, nejméně bolestivé jsou lymfomy. Nádorové onemocnění močového měchýře a prostaty se stává obvykle bolestivými až při prorůstání tumoru do okolních tkání.
Bolesti způsobené vlastním nádorem lze schematicky dělit na nociceptivní bolesti periostální, bolesti měkkých tkání, bolesti povrchové, bolesti viscerální, neuropatické, ischemické; bolesti charakteru reflexní sympatikové dystrofie a bolesti centrální při nádorovém či ischemickém postižení některých mozkových (talamus) nebo míšních struktur. Mezi organické příčiny těchto bolestí u onkologických pacientů patří:
- invaze do kostí (kostní nádory, kostní metastázy, prorůstání do kostí, následné patologické fraktury) infiltrace měkkých tkání
- komprese a infiltrace cév s jejich následnou okluzí
- lymfedémy s následnými poruchami prokrvení
- nekrotizující nádory sliznic a kůže s ulceracemi a perforacemi
- infiltrace vnitřních orgánů
- obstrukce dutých orgánů
- mechanické napínání orgánových pouzder a fascií
- svalové spazmy
- komprese, infiltrace a ischemizace nervů a nervových pletení
- komprese, infiltrace a ischemizace míchy,
- zvýšený nitrolební tlak (růst nádoru, metastázy, kolaterální nebo difúzní mozkový edém, váznoucí žilní návrat),
- infiltrace, prokrvácení nebo ischemizace některých mozkových struktur (talamus)
- iritace mozkových plen.
Základním cílem léčby onkologické bolesti je zlepšení kvality života pacienta. Zpočátku se snažíme o zabezpečením klidného, bolestí nerušeného spánku, následně o utlumení klidových a nakonec i pohybových a průlomových bolestí. Cílem léčby není bezpodmínečné dosažení stavu úplně bezbolestnosti ani utlumení bolesti na úkor výrazných nežádoucích účinků. Vždy musí převládat prospěch terapie nad nežádoucími účinky. Nedílnou součástí úspěšné farmakoterapie bolesti je i důkladné poučení pacienta o možných nežádoucích účincích léků, o možnostech jejich léčby nebo jejich předcházení. Pacienti by měli z ambulance lékaře odcházen nejenom se základní terapií pro tlumení setrvalých bolestí, ale i s medikací pro
léčbu bolestí průlomových (náhle, krátkodobě zhoršené) event. s léky proti nejčastějších nežádoucích účinkům.
Farmakoterapie bolesti:
Základní strategie farmakologické léčby onkologické bolesti vychází ze třístupňového žebříčku léčby bolesti poprvé publikovaného WHO v roce 1986. Pro svoji jednoduchost a schematičnost byl posléze přejat i pro léčbu bolesti neonkologické. Dle žebříčku začíná léčba bolesti podáváním neopioidních analgetik (metamizol, paracetamol, nesteroidní antiflogistika), při nedostatečném efektu se přidává slabý opioid (kodein, tramadol), který je ve III. stupni terapie vystřídán opioidem silným (morfin, fentanyl, buprenorfin, hydromorfon a další). Toto pravidlo však není zcela striktní, v některých případech lze přeskočit II. stupeň terapie a k neopioidnímu analgetiku přidat rovnou malou dávku opioidu silného. Jedná se především o onkologické pacienty, kde předpokládáme rychlejší navyšování dávky analgetik.
Analgetický žebříček WHO
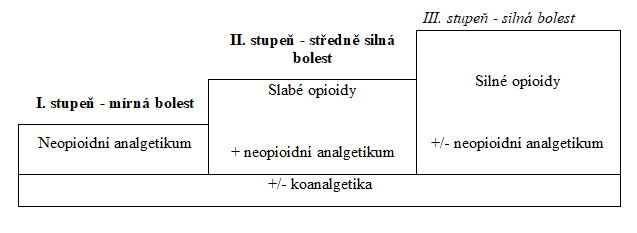
Neopioidní analgetika
Neopioidní analgetika zahrnují paracetamol s metamizolem a strukturálně nesourodou skupinu nesteroidních antiflogistik (NSA).
Paracetamol – analgetikum bez protizánětlivého účinku. Doporučené dávkování je 500 – 1000 mg po 4-6 hodinách. Výraznější analgetický efekt je u dospělého patrný až od 625 mg v jednotlivé dávce výše, nižší dávkování má převážně antipyretický účinek. Rychlost nástupu je 30-60 minut, maximální denní dávka je 4 000 mg. Při vyšším dávkování hrozí riziko hepatotoxicity. Jako dlouhodobě bezpečná dávka je považována 2,5 gramu denně. Výraznou výhodou paracetamlu je jeho velmi dobrá snášenlivost a možnost kombinací s ostatními analgetiky.
Metamizol je analgetikum s nástupem účinku 30 minut, obvyklé dávkování je 500 mg 4 x denně. Riziko vzniku agaranulocytózy je relativně malé, protoje vhodný o k dlouhodobému používání.
Nesteroidní antiflogistika
Princip účinku nesteroidních antiflogistik spočívá převážně v blokádě enzymů cyklooxygenázy (COX), která mění kyselinu arachidonovou na prostaglandiny. Existují dva izoenzymy COX-1 a COX-2. Forma COX-1 je syntentizována v řadě orgánů (játra, ledviny, žaludeční sliznice, krevní destičky) a podílí se na jejich fyziologické funkci. COX-2 forma je v malém množství přítomna v buňkách macula densa a v mozku. Jejich hladina výrazně stoupá při zánětu a traumatu. Vedle tohoto principu účinku se může na výsledném efektu podílet i ovlivnění serotoninergního systému mozku a ovlivnění bradykininem a cytokiny navozené hyperalgézie pomocí inhibice uvolňování TNF-α.
Podle selektivity blokády obou forem COX se nesteroidní antiflogistika dělí na COX-1 preferenční, COX neselektivní, COX-2 preferenční a COX-2 specifická (koxiby).
Klasickým zástupcem COX-1 preferenčních je kyselina acetylosalicylová. Dobrý analgetický efekt dávek 250-1000 mg je převážen výrazným rizikem vzniku vředové choroby gastroduodena, poruchami krvácivosti a možností renálního poškození.
COX nespecifická analgetika jsou zastoupena ibuprofenem, diclofenakem, naproxenem, indometacinem, ketoprofenem, piroxicamem a některými dalšími (většinou volně prodejnými) látkami. Nespecifická nesteroidní analgetika antiflogistika jsou vhodná pro krátkodobější léčbu bolestí u pacientů bez zvýšeného rizika plynoucího z nižší COX-2 selektivity (dyspepsie, vředová choroba gastroduodena, medikace kortikoidy, užívání antikoagulancií, renální poškození). Nespecifická NSA jsou k dispozici ve formě tablet s krátkodobým i retardovaným účinkem, čípků, gelů, sprayů, mastí a injekcí. Čípková ani injekční forma aplikace však nikterak nesnižuje riziko vzniku žaludečních a duodenálních vředů.
COX-2 preferenční analgetika jsou zastoupena nimesulidem a meloxicamem.
Nimesulid je lépe snášen než ostatní neselektivní NSA. Dle současného názoru SÚKL a EMEA (Evropská léková agentura) není jednoznačně vyvrácené riziko možného vzniku jaterního selhání při dlouhodobějším podávání. Délka nepřerušeného podávání nimesulidu by neměla překročit 15 dnů. Rychlost nástupu účinků (15-30 minut) předurčuje nimesulid k léčbě jak chronické, tak akutní nebo průlomové bolesti, dodáván je ve formě tablet i rozpustného granulátu.
Meloxicam vykazuje obdobnou snášenlivost, nemá prokázané hepatotoxické riziko, ve srovnání s nimesulidem má pomaleji nastupující, ale dlouhodobější účinek. Dodáván je ve formě tablet a čípků. Doba nástupu účinku je 90 minut.
COX-2 selektivní NSA (koxiby) jsou zastoupeny na českém trhu celecoxibem, etoricoxibem a intravenózním parecoxibem (Dynastat) . Výhoda koxibů spočívá především v nízkém výskytu nežádoucích účinků při zachování dobrého analgetického efektu. Je u nich však zvýšené riziko nežádoucích kardiovaskulárních příhod.
Celecoxib je lékem s velmi dobrou snášenlivostí. Stejně jako ostatní koxiby je zdravotními pojišťovnami částečně hrazen pouze u pacientů s prokázanými žaludečními nebo duodenálními vředy, trvale medikující kortikoidy nebo užívající antikoagulancia. Maximální dávka celecoxibu je 200 mg 2 x denně, doba nástupu je 45 minut.
Parecoxib je jediným zástupcem koxibů v parenterální formě. Analgetický efekt je rychlejší a krátkodobější něž u perorálních forem. Je určen především pro léčbu pooperační bolesti.
Etoricoxib je nejnovějším a nejselektivnějším analgetikem ze skupiny koxibů. Doporučená denní dávka je 60–120 mg denně, rychlost nástupu má 30 minut, analgetický efekt přetrvává 24 hodiny.
Základní zásady používání neopioidních analgetik:
- Jsou indikována v monoterapii k léčbě mírné a středně silné bolesti. Pro léčbu silné bolesti je třeba vždy kombinace s opioidy.
- Pokud po nasazení těchto léků v maximální dávce není do 24-36 hodin dosaženo zmírnění bolesti na snesitelnou míru (VAS maximálně 2-3/10), je indikován přechod na analgetika II. stupně dle žebříčku WHO.
- Zvyšování dávek neopioidních analgetik nad uvedenou maximální denní dávku obvykle nevede k posílení analgetického účinku, ale k zvýšení rizika závažných nežádoucích účinků.
- Existuje velká variabilita účinku (a nežádoucích účinků) jednotlivých analgetik u daného pacienta. Někdy je výhodné vyzkoušet jiné neopioidní analgetikum.
- Kombinace paracetamolu a metamizolu s nesteroidními antiflogistiky (NSA) zvyšuje analgetický účinek.
- Kombinace více nesteroidních antiflogistik není racionální a zvyšuje riziko nežádoucích účinků.
Opioidní analgetika
Opioidy působí na specifické opioidní receptory především v centrálním nervovém systému. Přítomnost opioidních receptorů je však prokázána i v periferním nervovém systém či některých jiných tkáních (např. trávicí trakt, kde se podílejí na vzniku opioidy indukované obstipaci). Podle vztahu k opioidním receptorům dělíme opioidy na:
1. čisté agonisty - morfin, petidin, piritramid, dihydrokodein, kodein, oxykodon, hydromorfon, fentanyl, sufentanil a tapentadol, který však není určen k léčbě onkologické bolesti.
2. parciální agonisty – buprenorfin.
3. smíšené agonisty/antagonisty - pentazocin, nalbufin. Smíšení antagonisté by neměli být v léčbě chronické bolesti používány pro svůj relativně slabší účinek a zejména pro možné antagonizování účinku silnější opioidních analgetik.
Podle síly analgetického účinku se opioidy dělí na:
1. slabé opioidy - dihydrokodein, kodein, tramadol.
2. silné opioidy - morfin, piritramid, buprenorfin, fentanyl, sufentanil, oxykodon, hydromorfon a další.
Dělení opioidů na slabé a silné je používáno v praxi v rámci analgetického žebříčku WHO. Z farmakologického hlediska však patří všechny opioidy do jedné skupiny.
Kodein je slabým m-agonistou. V organismu je biotransformován na morfin. Často je používán v kombinaci s kyselinou acetylosalicylovou nebo paracetamolem. Jednotlivá analgetická dávka v monoterapii je minimálně 60 mg, při kombinaci s neopioidními analgetiky dochází k potenciaci analgetického účinku.
Dihydrokodein je semisyntetický analog kodeinu. K dispozici je retardovaný dihydrokodein, který lze podávat v dávkách 60, 90 a 120 mg po 12, případně i 8 hodinách.
Tramadol působí jako slabý m-agonista, zároveň i působí inhibičně na absorpci aminů a tím na aktivaci monoaminergních spinálních mechanismů tlumení bolesti. Obvyklá perorální dávka je 50-100 mg po 4-6 hodinách, případně retardovaná forma po 8-12 hodinách. Maximální denní dávka je 400-600 mg. Tramadol by se neměl kombinovat se SSRI a duálními (NSRI) antidepresivy (riziko vzniku serotoninergního syndromu).
Kombinace slabých opioidů s neopioidními analgetiky zvyšuje celkový analgetický efekt s následnou možností snížení dávky a omezení výskytu nežádoucích účinků této terapie.
Morfin je lékem volby u nejsilnějších bolestí. Jeho dávkování je titrováno až do dosažení adekvátní úlevy od bolesti, není u něj znám tzv. stropový efekt. Většina nemocných nepotřebuje více než 200-300 mg/den. Morfin se používá buď ve formě magistraliter připravovaných sirupů a čípků nebo ve formě firemně vyráběných tablet s rychlým (IR) nebo retardovaným (SR) účinkem. V současné době, kdy je na trhu dostupná celá řada jiných silných opioidů, je hlavním důvodem používání morfinu jeho nízká cena.
Preparáty s rychlým uvolňováním morfinu jsou vhodné pro nastavení dávky nebo jako záchranná medikace při průlomových bolestech. Počáteční dávka je 10 mg po 4 hodinách.
Jakmile je dosaženo účinného a přetrvávajícího útlumu bolesti, je možné přejít na udržovací léčbu preparáty s řízeným uvolňováním morfinu. Tyto přípravky jsou podávány 2x denně. Počáteční jednotlivá dávka bývá obvykle 10-30 mg.
Poslední dobou si stále větší oblibu získávají transdermální aplikace léků. První opioidní analgetikum pro transdermální aplikaci se ve světě objevilo před 12 roky (TTS fentanyl). Českým pacientům je k dispozici od roku 1998. V současné době jsou na trhu v České republice v náplasťové formě k dispozici dvě opioidní látky. První z nich je buprenorfin, který svojí silou účinku stojí na hranici mezi silnými a slabými opioidy, druhý z nich je fentanyl, látka 100 x silnější než morfin. Každý výrobce dává k dispozici několik sil náplastí, aby bylo možno dávku analgetika individuálně přizpůsobovat potřebě pacienta.
Princip transdermálního podávání léků využívá schopnosti některých látek prostupovat přes kůži a následně se cestou drobných kožních cév dostávat do krevního oběhu. Tato schopnost je dána především fyzikálními vlastnostmi účinné látky. Ta musí mít malou velikost molekuly (do 1000 D), musí být dobře rozpustná v tucích a musí být dostatečně účinná. V náplasti je účinnou látkou napuštěn vlastní materiál náplasti, která dle výrobce má 2-4 vrstvy. Starší, rezervoárový systém, byl již většinou výrobců zcela opuštěn.
Léčba průlomové bolesti:
Průlomová bolest je dle Doporučených postupů pro léčbu průlomové bolesti definována jako „ Přechodné vzplanutí intenzivní bolesti, které přichází spontánně nebo je vyvoláno působeních specifického či nepředvídatelného faktoru i přes relativně stabilní kontrolu základní bolesti“. Setkáváme se s ní u pacientů s dostatečně pokrytou základní bolestí, zpravidla retardovanou nebo transdermální formou opioidu, u kterých se občas (maximálně 4 x denně) objeví krátkodobá ataka velmi silné bolesti. V případě, že se ataky objevují častěji, je vhodné navýšení základní analgetické terapie.
Průlomová bolest postihuje 60–85 % pacientů, je charakterizována nástupem během několika vteřin až minut a krátkou dobou trvání. U většiny pacientů dosahuje průlomová bolest svého maxima během 5-15 minut, většinou je obtížně předvídatelná, 48% pacientů udává, že záchvat nedokážou nikdy předpovědět, 19% pacientů je schopno ataku občas předvídat a pouze 19% pacientů udává, že příchod ataky poznají vždy. Střední doba trvání průlomové bolesti je 30-60 minut, její nástup je u pacientů spojen s poklesem funkční kapacity, nárůstem anxiosity a deprese. Celkově pacienti s nedostatečně léčenou průlomovou bolestí udávají výrazně menši spokojenost s léčbou. Optimálním lékem pro léčbu průlomové bolesti jsou extrémně rychle nastupující analgetikum s krátkodobým efektem. Jeho farmakokinetika by v optimálním případě měla kopírovat rychlost nástupu a délku trvání průlomové bolesti. Mezi neúčinnější léky na průlomovou bolest patři transmukózní formy fentalnylu. Fentanyl je vysoce lipofilní syntetický µ opioidní agonista 90-100x silnější než morfin. V současné době jsou k dispozici na českém trhu transmukózní fentanyly s intranasální, sublingvální a transbukální aplikační cestou.
Pravidla farmakologické léčby:
1. Při léčbě se řídíme především pacientovým údajem o intenzitě a charakteru bolesti
2. Cílem léčby nemusí být vždy úplná bezbolestnost. Je však nutné dosáhnout zmírnění
bolesti na subjektivně dobře snesitelnou úroveň.
3. Analgetika nasazujeme postupně podle síly jejich účinku. Schematicky tento přístup
znázorňuje třístupňový analgetický žebříček WHO.
4. Je výhodné kombinovat léky ze skupiny neopioidních analgetik se slabými nebo
silnými opioidy.
5. Pomocné léky (adjuvantní analgetika, koanalgetika) podáváme současně
s analgetiky podle charakteru bolesti .
6. Analgetika podáváme v pravidelných časových intervalech (podle hodin). Délka
intervalu závisí na farmakokinetických vlastnostech jednotlivých léků a lékových
forem.
7. K zajištění dostatečné kontroly bolesti při její kolísavé intenzitě (tzv. průlomové
bolesti) je někdy třeba kombinovat lékové formy opioidů s dlouhým účinkem
s lékovými formami s rychlým uvolňováním (např.transdermální fentanyl
a morfinový sirup).
8. Dávku analgetika stanovujeme vždy individuálně podle analgetického účinku
a nežádoucích účinků. V učebnicích uváděné doporučené a maximální dávky silných
opioidů mají informativní charakter, často je zapotřebí dávek vyšších.
9. Dáváme přednost co nejméně invazivnímu způsobu podání. Pro dlouhodobou léčbu je
výhodné podání perorální a transdermální. V případě nemožnosti těchto způsobů
podání lze některá analgetika podávat rektálně.
10. Pouze menšina nemocných potřebuje k tlumení chronické bolesti injekční analgetika.
Léky lze podávat formou jednotlivých dávek v pravidelných intervalech nebo formou
kontinuální subkutánní nebo intravenózní infuze. Ke kontinuální aplikaci je výhodné
užití přenosných infúzních pump (lineárních dávkovačů).
11. Pravidelně kontrolujeme analgetickou účinnost a výskyt nežádoucích účinků. Výskyt
nežádoucích účinků není důvodem k přerušení podávání analgetik, ale k léčbě a
řešení těchto nežádoucích účinků.
12. Pacientovi je třeba vystavit písemný časový plán užívání léků s informací o důvodu
jejich nasazení a kontakt na lékaře pro případ výskytu závažných nežádoucích účinků.
13. Pacienta je třeba poučit o pravidlech užívání volně prodejných léků a přípravků
k léčbě bolesti či potravinových doplňků na bolest a uklidnění.
14. O úspěšné farmakologické léčbě bolesti lze hovořit pouze pokud prospěch z analgezie
jasně převyšuje zátěž nežádoucích účinků.
Literatura:
1. Doležal T., Hakl M., Kozák J. et al. Metodické pokyny pro farmakoterapii nádorové bolesti. Farmakoterapie, 2006, 3: 281-286.
2. Cherny N. The management of cancer pain. Cancer J Clin 2000;50:70-116.
3. Vitte, C., Fleisch, H., Gunther, H.: Bisphosphonates induce osteoclasts to secrete an inhibitor of osteoclast-mediated resorption. Endocrinology 1996;137:2324-2333.
4. Adam Z., Ševčík P., Tomíška M et. al. Farmakologická léčba chronické bolesti a patologických osteolytických procesů. MU Brno 2000:50.
5. Body JJ. Bone metastases. In Klastersky J., Schimpff S., Senn H. Supportive Care in Cancer. Marcel Dekker, Inc. 1999: 453-481.
6. Berenson, J.R., Rosen, L.S., Howell, A. et al.: Zoledronic acid reduces skeletal-related events in patients with osteolytic metastases. Cancer 2001; 91:1191-1200.
7. Kovaříková J., Kovařík J. Paliativní radioterapie kostních metastáz. Bolest 2003;6,4:225-229.
8. Kabelka L., Kozák J., Lejčko J., Sláma O. Doporučený postup pro léčbu průlomové bolesti. Bolest 2011;14, suppl 1.
9. Webster LR: Breakthrough Pain in the Management of Chronic Persistent Pain Sydromes. Am J Manag Care, 2008; 14:116-122
10. Dickman A. Integrated strategies for the successful management of breakthrough cancer pain. Curr Opin Support Palliat Care. 2011;5: 8–14.
11. Fortner BV, Okon TA, Portenoy RK. A survey of pain-related hospitalizations, emergency department visits, and physician office visits reported by cancer patients with and without history of breakthrough pain. J Pain. 2002;3:38–44.

 Nechci bolest
Nechci bolest