Metamizol a jeho pozice v léčbě bolesti
Prim. MUDr. Marek Hakl, PhD
Pro léčbu chronické i akutní bolesti máme v současné době k dispozici celou řadu účinných analgetik. Vybírat můžeme ze skupiny neopioidních i opioidních analgetik. Každá skupina má však své výhody i zápory. Najít optimální lék není vždy zcela jednoduché. Jako jedno z optimálních analgetik se jeví metamizol. Tento lék vyniká velmi dobrým analgetický a antipyretickým efektem, s výhodou je i jeho efekt spasmolytický. S tímto lékem byla provedena řada studií, které porovnávali jeho účinnost i výskyt nežádoucích účinků. Jedna z těchto studií porovnávala metamizol a tramadol. Závěr studie vyznívá ve prospěch metamizolu. Zatímco analgetický efekt byl téměř totožný, ve skupině s metamizolem byl výrazněji nižší výskyt pooperační nauzei a zvracení.
Úvod
Bolest je jedním z prvních vjemů, s nímž se člověk ve svém životě setkává a který ho doprovází po celou dobu jeho existence. Světová zdravotnická organizace (World Health Organization, WHO) i Mezinárodní organizace pro studium bolesti (International Association for the Study of Pain, IASP) definují bolest jako „nepříjemný senzorický a emocionální prožitek spojený se skutečným či možným poškozením tkání nebo zážitek, který je v termínech takového poškození popisován; bolest je vždy subjektivní“.
Chronická bolest patří k nejrozšířenějším medicínským problémům současnosti s výrazným socio-ekonomickým dopadem. Prevalence chronické bolesti v ekonomicky vyspělých státech se udává kolem 20 %.
Obdobné výsledky vykazují i studie prováděné u populace v České republice; jedno z mála českých sledování uvádí, že bolest je příčinou asi 20 % návštěv u praktického lékaře.
Farmakoterapie bolesti
Cílem léčby je zmírnění až odstranění bolesti, zvýšení funkční kapacity, zajištění nerušeného spánku a celkové zlepšení kvality života.
Strategie léčby bolesti vychází z třístupňového analgetického žebříčku WHO, publikovaného poprvé v roce 1986 a původně určeného pro léčbu nádorové bolesti. Záhy byl však zcela přejat pro léčbu bolesti nenádorové, akutní i chronické. Žebříček je tvořen třemi základními stupni léčby, první stupeň pro nejméně intenzivní bolest zahrnuje neopioidní analgetika, druhý stupeň pro intenzivnější bolest přidává k neopioidním analgetikům slabý opioid a ve třetím stupni je slabý opioid nahrazen opioidem silným. Celou léčbu je možné doplňovat koanalgetiky (antikonvulzivy, antidepresivy) pro léčbu specifických bolestivých stavů a adjuvantní medikací k potlačení nežádoucích účinků analgetik (antiemetiky, laxativy). V indikovaných případech nádorové bolesti lze nově použít systém „výtah“ („elevator“), kdy při velmi intenzivní bolesti analgetik je možné druhý stupeň léčby (slabý opioid + neopioidní analgetikum) přeskočit a na léčbu neopioidními analgetiky navázat přímo podáváním nízkých dávek silného opioidu.
Třístupňový žebříček léčby bolesti
|
|
|
III. stupeň – silná bolest |
|
|
I. stupeň – mírná bolest |
II. stupeň – středně silná bolest |
Silné opioidy +/– neopioidní analgetikum |
|
|
Slabé opioidy + neopioidní analgetikum |
|||
|
Neopioidní analgetikum |
|||
|
_________________________________________________________________________________ |
|
||
Neopioidní analgetika
Neopioidní analgetika tvoří chemicky různorodou skupinu. Ta zahrnuje paracetamol s metamizolem a skupinu nesteroidních antirevmatik (NSA).
Paracetamol je analgetikum bez protizánětlivého účinku, doporučené dávkování je 500–1 000 mg po 4–6 hodinách. Výraznějšího analgetického účinku dosahuje paracetamol podávaný v jednotlivé dávce 650 mg a vyšší; nižší dávkování má převážně antipyretický účinek. Účinek nastupuje za 30 minut, maximální denní dávka je 4 000 mg. Při vyšším dávkování hrozí riziko hepatotoxicity, která však není vyloučena ani při dlouhodobějším užívání nižších dávek (2–3 g/denně).
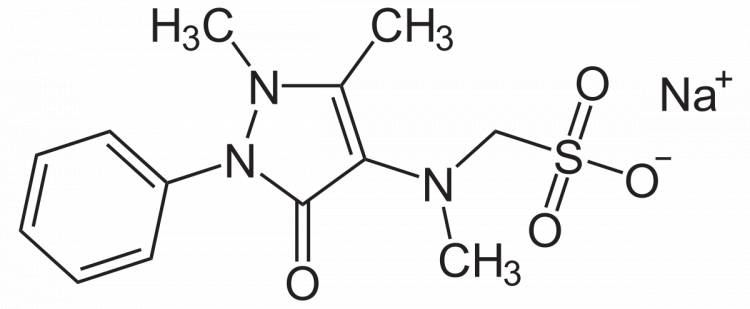
Metamizol je oblíbené neopioidní analgetikum se spasmolytickým efektem, které se v klinické praxi používá již od roku 1922. Metamizol má celou řadu výhod. Je lékem první volby u viscerální bolesti, velmi dobrý efekt má u bolestí hlavy a pacienti si jej chválí i u bolestí pohybového aparátu. Jeho velkou výhodou je minimální výskyt nežádoucích účinků a velmi dobrá kombinovatelnost i s ostatními analgetiky. V klinické praxi se velmi dobře osvědčil v léčbě bolesti pooperační, traumatické, nádorové, ale i neuropatické. U bolesti neuropatické je jedním z léků volby zejména v kombinaci s antikonvulzivy a silnými opioidy.
U metamizolu v léčbě chronické bolesti riziko závislosti nehrozí. Podle Oxyfordské ligy analgetik má metamizol nízké NNT – 1,6. Všeobecně analgetika s NNT nižším než 2 považujeme za vysoce účinná. Proto je metamizol ze skupiny neopioidních analgetik jednoznačně nejčastěji používán.
Metamizol dosahuje efektu pomocí centrálních a periferních mechanizmů. Avšak přesný mechanizmus účinku není znám. Předpokládá se, že je založený na blokádě enzymové aktivity cyklooxygenázy (COX), převážně typu 2. Toto je i základ jeho antipyretického efektu. Existuje předpoklad, že metamizol inhybuje i COX 3 izoformu, která snižuje syntézu prostaglandinů v zadních rozích míšních. Zdá se, že metamizol také působí stimulací kanabinoidních receptorů a pravděpodobně i přes opioidní receptory, protože naloxon částečně inhibuje jeho analgetickou aktivitu.
Právě kvůli spasmolytickému efektu se používá kromě pooperační bolesti i v léčbě bolestí gastrointestinálního traktu, urogenitálního traktu, po operacích stomatologických i v terapii migrény.
Antipyretický účinek je zprostředkovaný blokádou jak PG dependentních, tak i PG nezávislých drahách, které jsou generovány horečkou indukovanými polysacharidy. Princip antipyretického efektu je tedy odlišný od efektu NSA.
Spazmolytický účinek je spojený s indukcí uvolňování intracelulárního Ca2+ v hladné svalovině v důsledku snížení syntézy inositolfosfátu.
Nesteroidní antirevmatika
Princip účinku NSA spočívá převážně v blokádě enzymů cyklooxygenázy (COX), která mění kyselinu arachidonovou na prostaglandiny. Existují dva izoenzymy – COX-1 a COX-2. Forma COX-1 je syntentizována v řadě orgánů (játra, ledviny, žaludeční sliznice, krevní destičky) a podílí se na jejich fyziologické funkci.
Podle COX II selektivity rozlišujeme COX II neselektivní (diclofenak, ibuprofen, indometacin, naproxen…..), COX II preferenční (meloxicam, nimesulid), a COX II selektivní tzv. koxiby (parecoxib, celecoxib, etoricoxib)
Dlouhodobé užívání zejména COX II neselektivních NSA zvyšuje riziko poškození ledvin a vzniku ulcerací a krvácení v trávicím ústrojí. Riziko krvácení je u seniorů čtyřikrát vyšší než u mladší části populace; vhodné je souběžné podávání antiulcerózní léčby. Většinou je doporučováno snížení celkové dávky NSA.
Pravidla používání neopioidních analgetik:
- Neopioidní analgetika jsou indikována v monoterapii k léčbě mírné a středně silné bolesti. Pro léčbu silné bolesti je třeba vždy kombinace s opioidy.
- Zvyšování dávek neopioidních analgetik nad uvedenou maximální denní dávku obvykle nevede k posílení analgetického účinku, ale ke zvýšení rizika vzniku závažných nežádoucích účinků.
- Existuje velká variabilita účinku (a nežádoucích účinků) jednotlivých analgetik u daného pacienta. Někdy je výhodné vyzkoušet jiné neopioidní analgetikum.
- Kombinace paracetamolu nebo metamizolu s NSA zvyšuje analgetický účinek.
- Kombinace několika NSA není racionální a zvyšuje riziko nežádoucích účinků.
Slabé opioidy
Codein je slabým agonistou na m-receptorech. V organismu je biotransformován na morfin. Často se používá v kombinaci s paracetamolem.
Dihydrocodein je semisyntetický analog codeinu. K dispozici je dihydrokodein v retardované formě, který lze podávat v dávkách 60–120 (180) mg po 12 hodinách, popřípadě i v osmihodinových intervalech.
Tramadol vykazuje duální účinek: jednak působí jako slabý agonista na m-receptorech, jednak ovlivňuje zpětné vychytávání serotoninu a noradrenalinu v CNS. Na trhu je přítomen v řadě aplikačních forem, od injekční přes čípkovou až po retardované tablety.
Tramadol je centrálně působící opioidní analgetikum. Tramadol je čistý neselektivní agonista μ, δ a κ opioidních receptorů, s vyšší afinitou k receptorům μ. Jiné mechanismy, které přispívají k jeho analgetickému účinku, jsou inhibice zpětného vychytávání norepinefrinu v neuronech a posílení uvolňování serotoninu. Tramadol má také antitusický účinek. Na rozdíl od morfinu nemá žádný tlumivý účinek na dýchání v širokém rozpětí terapeutických dávek. Stejně tak nemění gastrointestinální motilitu. Kardiovaskulární účinky jsou obecně slabé. Účinnost tramadolu se uvádí mezi 1/10 a 1/6 účinku morfinu.
Po perorálním podání se racemický tramadol rychle a téměř úplně vstřebá. Střední absolutní biologická dostupnost jednotlivé dávky 100 mg je přibližně 75 %. Při opakovaném podání biologická dostupnost stoupá a dosahuje přibližně 90 %.
Tramadol a jeho metabolity jsou vylučovány převážně ledvinami.
Porovnání účinnosti metamizolu s ostatními analgetiky
Metamizol byl porovnáván s celou řadou jiných analgetik zejména v pooperační bolesti. Jedna studie (Derry et al) porovnávala účinnost jednotlivého podání 500 mg metamizolu a 400 mg ibuprofenu per os. Analgetický potenciál obou léků byl stejný. Metamizol v dávce 1000 mg byl účinnější než ibuprofen v dávce 600 mg u pacientů po stomatologické extrakci třetího moláru. Při porovnání 500 mg metamizolu a 1000 mg paracetamolu vyšel lepší analgetický efekt u metamizolu.
Velice zajímavou studii provedl Torres et al. Jednalo se o randomizovanou dvojtě slepou studii, kdy pacientkám po hysterectomii byl podáván buď metamizol nebo tramadol.
Celkem bylo ve studii zařazeno 151 žen ve věku 18 až 60 roků, které byly indikovány k provedená abdominální hysterectomie prováděné v celkové anestezii. 73 pacientek dostalo metamizol a 78 pacientek dostalo tramadol. Pacientky dostaly intravenozní dávku analgetika ihned po ukončení operace a tato dávka byla následována kontinuálním podáváním léku s možností podání bolusu dle potřeby do maximální dávky 8 g metamizolu nebo 500 mg tramadolu. Délka sledování byla 24 hodin.
Průměrný počet bolusů ve skupině s metamizolem bylo 3,8 a ve skupině s tramadolem 3,5. Pacienti měli ještě možnost záchranné medikace morinem i.v, zde však rozdíl ve spotřebě nebyl signifikantní. Zatímco analgetický efekt obou léků byl srovnatelný, výraznější rozdíly byly ve výskytu nežádoucích účinků. Vyšší výskyt nežádoucích účinků byl ve skupině s tramadolem (42,1%), zatímco ve skupině s metamizolem byl výskyt výrazně nižší (20,2%). Výrazně vyšší počet pacientů s tramadolem vyžadoval podání antiemetika odansetronu v 1. hodině po operaci (19% versus 7%), 2 hodině (26% versus 11%) a ve 24. hodine (46% versus 29%). Závěrem autoři konstatují, že analgetický potenciáln obou dvou léků byl podobný, výrazně se však lišil výskyt nauzei a zvracení, která ve skupině s tramadolem byla výrazně vyšší.
Závěr:
Metamizol se jeví jako jedno z nejoptimálnějších analgetik v léčbě jak akutní, tak i chronické bolesti. Má široké spektrum indikací a jen minimální výskyt nežádoucích účinků. Studie porovnávající jeho efekt s NSA i tramadolem prokázaly, že má i velmi dobrý analgetický potenciál srovnatelný s ostatními analgetiky. Tyto vlastnosti řadí metamizol mezi analgetikum první volby u většiny typů bolestí.
Literatura:
- Jasiecka A, Maslanka T, Jaroszewski JJ. Pharmacological characteristics of metamizole. Pol J Vet Sci. 2014; 17:207-14. 6.
- Nikolova I, Voynikov Y, Tencheva J, PetkovaV. Metamizole: A review profi le of A well-known “forgotten” drug. Part I: Pharmaceutical and nonclinical profi le. Biotechnol. & Biotechnol. Eq. 2012; 26(6): 3329-3337.
- Miljković M, Rančić N, Dragojević-Simić V, Stamenković D. Metamizole for postoperative pain: PRO’s and CON’s. Proceedings 69-77. 25.
- Jasiecka A, Ma´slanka T, Jaroszewski JJ. Pharmacological characteristics of metamizole. Pol J Vet Sci. 2014; 17:207-14.

 Nechci bolest
Nechci bolest